- Нарушение в клетках организма процессов аутофагии;
- Нарушение клеточного апоптоза.
Наш организм очень сложная система.
Эту систему можно сравнить с нашим государством, где есть орган управления, есть исполнители.
У каждого органа свои функции. Каждый в отдельности самостоятельно существует, но всегда находится под контролем власти.
Если в какой-то клетке организма происходит сбой в работе, следом наступает процесс самоликвидации.
С самого рождения организм борется за своё существование.
Это борьба с вирусами, с бактериями, с мутирующими клетками.
В этой борьбе главный орган — «Иммунная система».
От её работы зависит защита человека от болезней, от преждевременного старения.
Наука ищет пути и возможности продления жизни человека.
В 1974 году Де Дюв получил Нобелевскую премию «за открытия, касающиеся структурной и функциональной организации клетки».
В 2016 году японский учёный Ёсинори Осуми получил Нобелевскую премию за исследование аутофагии в дрожжевых клетках и с помощью генетического подхода обнаружил полтора десятка генов, инактивация которых приводила к дефектам в образовании аутофагосом.

Эти гены были клонированы и секвенированы.
Исследование функционирования белковых продуктов этих генов привело в дальнейшем к выяснению молекулярных механизмов индукции, протекания и регуляции аутофагии.
Эти гены по современной номенклатуре называются ATG (Autophagy-related Genes).
В настоящее время открыто уже более тридцати генов ATG.
Осуми показал, что аутофагия — это действительно запрограммированный процесс, то есть процесс, который кодируется в геноме. Если мутировать или отключить важные для аутофагии гены, то аутофагии происходить не будет.
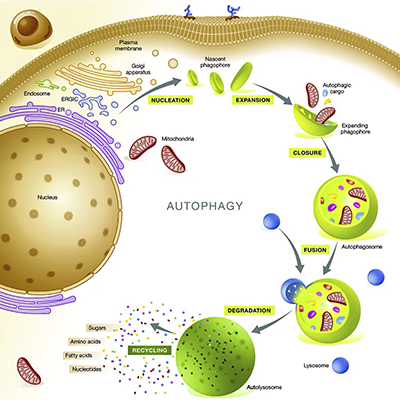
- Аутофагия.
— процесс, при котором внутренние компоненты клетки доставляются внутрь её лизосом или вакуолей и подвергаются в них деградации.
Является естественным, регулируемым механизмом клетки, который разбирает ненужные, неполноценные, дефектные или дисфункциональные компоненты.
При аутофагическом типе клеточной гибели все органеллы клетки перевариваются, оставляя лишь клеточный мусор, который поглощается макрофагами.
Термин «аутофагия» для способа доставки цитоплазматического материала клетки в лизосомы с целью последующей деградации ввел в 1963 году бельгийский биохимик Кристиан де Дюв, первооткрыватель лизосом.
Лизосомы — это клеточные органеллы, содержащие множество гидролитических ферментов, работающих в кислой среде.
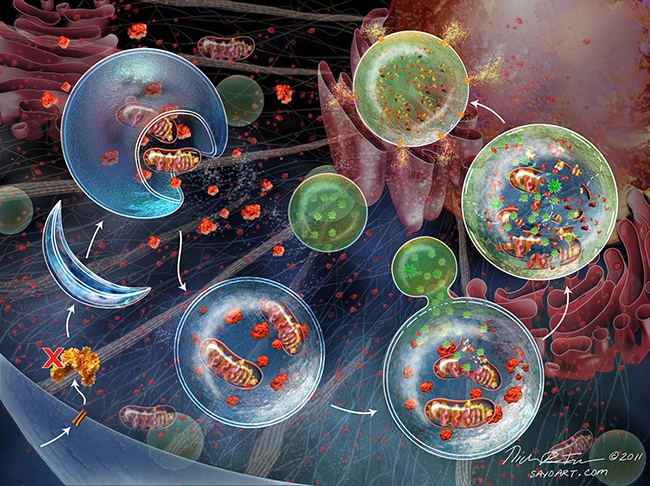
Впоследствии было обнаружено, что в процессе аутофагии в цитоплазме сначала образуются аутофагосомы — пузырьки, окруженные двухслойной мембраной, содержащие часть цитоплазмы и клеточные органеллы (митохондрии, рибосомы, фрагменты эндоплазматического ретикулума).
Аутофагосомы далее сливаются с лизосомами, в образовавшихся при этом аутолизосомах происходит деградация макромолекул и органелл в результате действия лизосомных ферментов — гидролаз.
Аутофагия – это механизм избавления от всех выполнивших свою роль старых клеточных структур – органелл (своеобразные «органы» клетки), белков, жиров, углеводов, компонентов клеточных мембран и многого другого.
Аутофагия – это создание своеобразного мусорного «мешка» – аутофагосомы – для сбора старых клеточных компонентов, которые потом переносятся в «пункт приема утильсырья» – лизосомы – органеллы клетки, где они разбираются на части и затем могут быть переработаны в новые компоненты клетки.
С помощью аутофагии клетка избавляется от дефектных белков и органелл.
Особенно это актуально для неделящихся долгоживущих клеток, таких как нервные клетки.
При нейродегенеративных заболеваниях в нейронах накапливаются агрегаты неправильно свернутых белков, например бета-амилоида при болезни Альцгеймера и альфа-синуклеина при болезни Паркинсона.
Для правильной работы аппарата аутофагии необходим баланс между образованием аутофагосом и их деградацией в лизосомах.
Нарушение этого баланса приводит к гибели нервных клеток.
Показано, что повышенная аккумуляция аутофагосом в нейронах ассоциирована с нейродегенеративными заболеваниями (болезнями Альцгеймера, Паркинсона, Хантингтона). К этим же заболеваниям приводят мутации ATG-генов.
Недостаточная переработка отслуживших компонентов приводит к их накоплению внутри клетки, что в свою очередь приводит к старению самой клетки, её болезням и смерти.
Аутофагия регулирует баланс белкового состава клетки в частности, предотвращает накопление токсичных отходов, поддерживает функции клеточных органелл (особенно ядра и митохондрии), удаляет чужеродные агенты и поддерживает клетки в периоды голодания.
Механизмы аутофагии запрограммированы генетически. В молодом возрасте они работают нормально. С годами, в процессе старения, они ослабевают, что приводит к собственно старению клетки, ткани и организма в целом, болезням, ассоциированным со старением и смерти.
Больше всего аутофагия контролируется белком, именуемым mTOR.
mTOR активируется компонентами Фаговита (специфические агенты Фаговита – САФ).
САФ также включают дополнительные механизмы запуска аутофагии.
Когда клетки организма работают нормально, аутофагия находится на низком уровне, помогая перерабатывать износившиеся компоненты клетки. Это своего рода режим поддержания. Но когда клетки оказываются под воздействием стресса, механизм аутофагии активируется и спешит защитить наш организм (реакция на стресс). С возрастом реакция на стресс ослабевает и человек стареет.
Процесс старения можно представить, как нарушение гомеостаза (постоянства внутренней среды) – организму по мере взросления и старения становится все труднее контролировать самого себя и поддерживать все системы в состоянии равновесия и здоровья.
С нарушениями процесса аутофагии происходит накопление поврежденных, дефектных, неполноценных веществ, т.к. аутофагия не достигает нормального функционального уровня. Повышение уровня аутофагии противодействует старению организма.
По научным сведениям, продолжительность жизни и здоровья можно увеличить с помощью специфических агентов Фаговита (САВ). Они стимулируют аутофагию – цитоплазматический процесс рециклизации.
При болезни Хантингтона аутофагия удаляет белок гентингтин,
у пациентов с болезнью Альцгеймера – β-амилоиды,
у пациентов с деменцией – тау-белок,
у пациентов с болезнью Паркинсона – ɑ-синуклеин.
Это важно также и в профилактике данных заболеваний, и для повышения умственных способностей здоровых людей.
Аутофагия способствует борьбе с инфекционными заболеваниями – напрямую удаляя микробы из клеток (ксенофагия), удаляя токсины, связанные с инфекцией, регулируя иммунный ответ на инфекцию. В т. ч. микобактерии туберкулеза, стрептококк группы А, вирусы (ВИЧ, гепатит, герпес, папиломавирус и пр.) удаляются из организма при помощи процессов аутофагии.
Аутофагия помогает регулировать воспаление.
В зависимости от процесса, аутофагия может как усиливать, так и ослабевать воспаление в организме.
Если организму требуется усиление воспаления в период острой стадии заболевания
– Фаговит усиливает его, включает иммунный ответ, аутофагия очищает клетку от антигенов, которые стимулируют ответ.
Аутофагия, улучшая мышечную деятельность (Фаговит рекомендован спортсменам), поддерживает баланс использования энергии в клетках, снижает потребность во внешних источниках энергии.
Разрушенные клеточные компоненты удаляются до того, как начинают вызывать проблемы.
Аутофагия играет значимую роль в предотвращении возникновения рака.
Аутофагия подавляет связанные с раком процессы, такие как хроническое воспаление, ответ на повреждения ДНК и нестабильность генома.
Аутофагия при атеросклерозе — способствует сгоранию клеток, инфильтрирующих атеросклеротическую бляшку. Бляшка стабилизируется и уменьшается. Стабильная бляшка неопасна.
2. Клеточный апоптоз.

Каждый день в организме погибает большое количество клеток, а на смену им образуется равное количество новых: таково условие для поддержания клеточного гомеостаза. Удалить необходимо ненужные, старые и потенциально опасные. Одним из известных механизмов клеточной гибели является апоптоз, представляющий собой программируемый процесс.
Иначе можно сказать, что смерть клетки происходит согласно контролируемой «суицидальной» программе, регулируемой на генетическом уровне. Кроме того, апоптоз характеризуется «аккуратностью» (в отличие от некроза): мембрана погибшей клетки остается целой, и, следовательно, содержимое клетки не покидает ее границ, а воспалительная реакция не активируется. Этот механизм имеет важное значение для медицины, так как лежит в основе развития многих заболеваний.
Когда активируется апоптоз?
Физиологические ситуации:
- Разрушение клеток в процессе эмбриогенеза. Начальный этап развития организма сопровождается образованием избыточного клеточного материала, уничтожение которого происходит путем апоптоза в строго определённых местах и времени. Иначе говоря, гистогенез и органогенез тесно связаны с активацией апоптоза. Пример: удаление перепонок между зачатками пальцев.
- Инволюция гормонозависимых тканей после прекращения гормональной стимуляции. Пример: разрушение эндометрия во время менструального цикла, атрофия яичников в период менопаузы, постлактационное уменьшение молочной железы и атрофия простаты после кастрации.
- Ликвидация потенциально опасных лимфоцитов, которые могут реагировать на собственные ткани.
- Смерть клеток, которые уже послужили во благо организму. Например, гибель нейтрофилов при остром воспалительном ответе и лимфоцитов в конце иммунного ответа.
Патологические ситуации:
- Поврежденная ДНК. Радиоактивные и цитотоксические противоопухолевые препараты, а также гипоксия могут повредить ДНК либо напрямую, либо через производство свободных радикалов. Если система репарации не может справиться с повреждением, то клетка активирует внутренние механизмы, которые индуцируют апоптоз. Это является лучшей стратегией, так как существует риск злокачественного перерождения клеток.
- Накопление неправильно сложенных белков в эндоплазматическом ретикулуме. Это явление называется эндоплазматическим стрессом. Неправильно сложенные белки могут появится из-за мутаций в генах или при повреждениях свободными радикалами. Апоптоз, возникающий в результате таких накоплений, наблюдается, например, при нейродегенеративных заболеваниях (болезнь Альцгеймера, Паркинсона и др.).
- Гибель клеток при вирусных инфекциях. Потеря инфицированных клеток также обусловлена апоптозом, который может быть вызван вирусами (при аденовирусной и ВИЧ-инфекциях) или иммунной системой хозяина (при вирусном гепатите). За последнее отвечают цитотоксические Т-лимфоциты, которые убивают инфицированные клетки, устраняя резервуары инфекционного заболевания. Этот же механизм, опосредованный Т-клетками, наблюдается при гибели опухолевых клеток и при отторжении трансплантата.
Для нормализации процессов аутофагии и клеточного апоптоза Компания «Сово-Сова» создала базовые препараты:
Фаговит и супресен.

Фаговит способствует предотвращению нейродегенеративных нарушений клеток головного мозга; удаляет патологические белки, микробы из клеток; удаляет токсины; регулирует процессы воспаления в организме; замедляет рост раковых клеток; способствует сгоранию клеток инфильтрирующих атеросклеротическую бляшку.
Подробнее о фаговите.

Один из самых важных продуктов компании «Сово-Сова». Предназначен для омоложения и профилактики заболеваний, расстройств ассоциированных со стареющими клетками.
Он способствует задержке и остановке возрастных расстройств и заболеваний.
Активизирует механизм запрограммированной гибели старых клеток. Облегчает их удаление и замену новыми.
Супресен удаляет до 20-25% старых клеток.