- Откуда берутся метилглиоксаль и конечные продукты гликирования (КПГ)?
- Метилглиоксаль (пирувальдегид, 2-оксопропаналь)
- Конечные продукты гликирования (КПГ)
- Гликированный гемоглобин
- Нормы гликированного гемоглобина.
- Фруктозамин
- Биологические эффекты конечных продуктов гликирования (КПГ).
- Глиоксалазная система
- Обзор глиоксалазного пути
- Регулирование глиоксалазного пути
- Медицинское применение. Фармакология
- Основные метаболические пути в глиоксалазном цикле
- Потенциальные подходы в борьбе с конечными продуктами гликирования.
Откуда берутся метилглиоксаль и конечные продукты гликирования (КПГ)?
- Продукты питания, получившие термическую обработку:
поджаривание (225°с), жарку во фритюре (180°С), выпекание в духовке (230°C) и обжарку (177°С).
Чемпионом по содержанию карбоксиметиллизина является жареный бекон. - Гликолиз белков с участием глюкозы и фруктозы при избытке в пище сладостей и фруктов.

Метилглиоксаль (пирувальдегид, 2-оксопропаналь) — альдегид пировиноградной кислоты, является одновременно альдегидом и кетоном.
В живых организмах метилглиоксаль образуется как побочный продукт нескольких метаболических путей.
Он может образоваться из 3-аминоацетона, промежуточного продукта катаболизма треонина, либо в процессе перекисного окисления липидов.
Однако, важнейший источник метилглиоксаля — гликолиз, где он получается в процессе неферментативного гидролиза фосфатной группы от глицеральдегид-фосфата и дигидроацетон-фосфата, двух промежуточных компонентов гликолиза.
Метилглиоксаль является цитотоксическим продуктом, поэтому в клетке существует несколько механизмов инактивации, в том числе глиоксалазная система.
Метилглиоксаль реагирует в клетке с глутатионом, образуя гемитиоацеталь, который превращается под действием глиоксалазы в S-D-лактоилглутатион,
и далее метаболизируется в D-лактат под действием глиоксалазы.
В силу своей реактивности метилглиоксаль играет большую роль в образовании поздних продуктов гликирования в процессе реакции Майяра.
Более того, он считается важнейшим из гликирующих реагентов (т. е. ковалентно связывающихся с амино-группами белков, таких как глюкоза, галактоза и др.), приводящих к нарушению функций белков при диабете.
Аэробный гликолиз, также известный как эффект Варбурга, преимущественно усиливается при различных солидных опухолях, в том числе при раке молочной железы. Ранее мы сообщали, что метилглиоксаль (МГ), очень реакционноспособный побочный продукт гликолиза, усиливает метастатический потенциал клеток тройного негативного рака молочной железы (TNBC).
Метилглиоксаль и продукты гликирования, образующиеся из МГ, связаны с различными заболеваниями, такими как диабет, нейродегенеративные расстройства и рак.
Конечные продукты гликирования (КПГ) — это белки или липиды, которые подверглись гликированию углеводами.
Они могут быть одним из факторов старения и развития или осложнения многих дегенеративных заболеваний, таких как диабет, атеросклероз, хроническая болезнь почек и болезнь Альцгеймера.
В организме КПГ возникают при некоторых патологических состояниях, таких как окислительный стресс, который часто возникает у пациентов с сахарным диабетом из-за гипергликемии. В белках, как правило, гликированию подвергаются остатки лизина, а также аргинина. По этой причине одним из наиболее распространённых КПГ является
N(6)-карбоксиметиллизин.
Гликопротеины, являющиеся КПГ, образуются неферментативно как результат реакции Майяра.
Клетки многих типов экспрессируют особый рецептор, известный как RAGE (от англ. receptor for advanced glycation endproducts).
Известны и другие клеточные рецепторы, связывающиеся с КПГ, в частности, OLR. Взаимодействие RAGE с КПГ, как принято считать, запускает экспрессию провоспалительных генов.
Гемоглобин — это железосодержащий белок. Он входит в состав эритроцитов — клеток крови. Гемоглобин переносит по организму кислород и придаёт крови красный цвет. Существует несколько разновидностей гемоглобина, но основной его тип — гемоглобин альфа-1 (HbA1).
Глюкоза — углевод, основной источник энергии для клеток. Она поступает с пищей, всасывается в кровь, циркулирует в ней и распределяется по органам и тканям. За обмен глюкозы и её оптимальный уровень отвечают два основных гормона поджелудочной железы — инсулин и глюкагон.
Если развивается заболевание поджелудочной железы или в рационе преобладают быстрые углеводы, организм перестаёт справляться с усвоением глюкозы.
Высокий уровень сахара в крови — гипергликемия — приводит к тому, что молекулы глюкозы начинают активно «склеиваться» с молекулами гемоглобина. Эта реакция называетя гликированием, а получившийся в её результате белково-углеводный комплекс — гликированным гемоглобином (HbA1c).
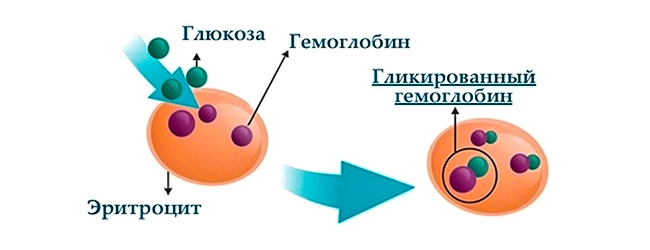
Освободиться от глюкозы такой гемоглобин уже не может. Он циркулирует в кровотоке вместе с эритроцитами вплоть до распада последних. Средний срок жизни красной кровяной клетки — около 120 дней.
Его используют для ранней диагностики сахарного диабета и предиабета, а также для контроля эффективности лечения этих заболеваний.

Нормы гликированного гемоглобина.
4-5.7% -нет сахарного диабета;
5,7-6.4% — преддиабет (нарушенная толерантность к глюкозе);
6,5% и выше — сахарный диабет имеется.
Таблица соответствия гликированного гемоглобина среднесуточному уровню глюкозы плазмы за последние три месяца.
Гликированный гемоглобин (%) | Среднесуточный уровень |
5,0 | 5,4 |
6,0 | 7,0 |
7,0 | 8,6 |
8,0 | 10,2 |
9,0 | 11,8 |
10,0 | 13,4 |
11,0 | 14,9 |
Гликированный белок— соединение в плазме крови, которое образуется в результате взаимодействия глюкозы с плазменными белками, преимущественно — с альбумином. Если в течение определенного времени содержание глюкозы сохраняется выше нормы, ее молекулы связываются с белками — происходит их гликирование (гликозилирование). Такие комплексы сохраняются на протяжении всего периода «жизни» белка, а их количественный показатель служит оценкой среднего уровня глюкозы в данный временной интервал.
Для контроля и мониторинга сахара в крови применяется исследование на гликированный гемоглобин. Жизненный цикл эритроцитов составляет 3-4 месяца, а плазменных белков — 2-3 недели, поэтому фруктозамин отражает степень повышения уровня глюкозы в течение 14-21 дня до сдачи анализа.
Биологические эффекты конечных продуктов гликирования (КПГ).
КПГ оказывают влияние на клетки практически всех типов и считаются одним из факторов, вносящих вклад в старение и развитие связанных со старением хронических заболеваний.
Показана роль КПГ в развитии болезни Альцгеймера, сердечно-сосудистых заболеваний, (в том числе инфаркта), а также сахарного диабета.
Основное токсическое действие КПГ связано с запуском образования поперечных сшивок между молекулами клеточных полимеров, что вызывает внутренние повреждения в клетках и в конце концов апоптоз.
При гипергликемии, в случае сахарного диабета или преддиабета, образование КПГ может запускаться в условиях окислительного стресса.
При сердечно-сосудистых заболеваниях КПГ могут вызывать образование поперечных сшивок волокон коллагена, что увеличивает жёсткость стенок сосудов и закрепление липопротеинов низкой плотности (ЛНП) на стенках артерий. КПГ могут также вызывать гликирование ЛНП, что способствует их окислению.
Окисленные ЛНП являются одним из факторов развития атеросклероза.
Кроме того, через связывание с вышеупомянутыми рецепторами RAGE КПГ могут вызывать окислительный стресс и активацию воспалительных сигнальных путей в клетках сосудистого эндотелия. Связываясь с RAGE на поверхности мононуклеарных фагоцитов и лимфоцитов, КПГ запускают образование свободных радикалов и экспрессию генов воспалительного ответа.
Помимо указанных выше патологических эффектов, КПГ накапливаются в хрусталике, нарушая функционирование кристаллина, и служат возможным риском развития катаракты.
Кроме того, КПГ нарушают работу скелетной мускулатуры.
Конечные продукты гликирования вызывают целый каскад опасных заболеваний и последствий:
- Сахарный диабет второго типа и инсулинорезистентность;
- Почечная недостаточность;
- Атеросклероз сосудов;
- Сокращают продолжительность жизни;
- Удлиняют время заживления ран и травм;
- Системное старческое воспаление;
- Тромбоз и закупорка сосудов;
- Сахарный диабет первого типа и другие аутоиммунные заболевания;
- Увеличение смертности от сердечно-сосудистых заболеваний.
Это набор ферментов, которые осуществляют детоксикацию метилглиоксаля и других реактивных альдегидов, образующихся в процессе метаболизма. Эта система была изучена как у бактерий, так и у эукариот.
Эта детоксикация осуществляется последовательным действием двух тиол-зависимых ферментов:
во-первых, глиоксалазы І, которая катализирует изомеризацию спонтанно образующегося гемитиоацетального аддукта между глутатионом и 2-оксоальдегидами (такими как метилглиоксаль) в S-2-гидроксиацилглутатион.
во-вторых, глиоксалаза II гидролизует эти тиоэфиры и в случае катаболизма метилглиоксаля образует D-лактат и GSH из S-D-лактоил-глутатиона.
Эта система демонстрирует многие типичные особенности ферментов, которые выводят из организма эндогенные токсины.
Во-первых, в отличие от широкого спектра субстратов многих ферментов, участвующих в метаболизме ксенобиотиков, она демонстрирует узкую субстратную специфичность.
Во-вторых, для её ферментативного механизма необходимы внутриклеточные тиолы,
В-третьих, система перерабатывает реактивные метаболиты обратно в форму, которая может быть полезна для клеточного метаболизма.
Обзор глиоксалазного пути
Глиоксалаза I (GLO1), глиоксалаза II (GLO2) и восстановленный глутатион (GSH).
В бактериях есть дополнительный фермент, который функционирует при отсутствии GSH, он называется третьим гликозилазным белком, глиоксалазой 3 (GLO3). GLO3 у людей пока не обнаружен.
Путь начинается с метилглиоксаля (МГ), который образуется в результате неферментативных реакций с DHAP или G3P, образующимися в ходе гликолиза.
Затем метилглиоксаль превращается в S-d-лактоилглутатион с помощью фермента GLO1 и каталитического количества GSH, который гидролизуется в нетоксичный D-лактат с помощью GLO2, при этом GSH восстанавливается и снова потребляется GLO1 с новой молекулой MG.
D-лактат в конечном итоге метаболизируется в пируват.
Регулирование глиоксалазного пути
Существует несколько низкомолекулярных индукторов, которые могут активировать глиоксалазный путь, либо стимулируя функцию GLO1 для увеличения преобразования MG в D-лактат, что называется активацией GLO1, либо напрямую снижая уровень MG или уровень субстрата MG, что называется поглощением MG. К активаторам GLO1 относятся синтетический препарат кандесартан и натуральные соединения ресвератрол, фисетин, бинарная комбинация транс-ресвератрола и гесперидина (tRES-HESP), мангиферин, аллил изотиоцианат, фенетил изотиоцианат, сульфорафан и бардоксолон метил, а к поглотителям MG относятся аминогуанидин, алагебриум и бенфотиамин. Существует также малая молекула пиридоксина, которая действует как активатор GLO1 и поглотитель MG.
Было обнаружено множество ингибиторов GLO1, поскольку активность GLO1, как правило, усиливается в раковых клетках.
Таким образом, GLO1 служит потенциальной терапевтической мишенью для противораковых препаратов и является предметом многих исследований, посвящённых его регуляции в опухолевых клетках.
Медицинское применение / Фармакология
Гипергликемия, побочный эффект, вызванный диабетом, в сочетании с окислительным стрессом приводит к образованию конечных продуктов гликирования (КПГ), которые могут вызвать диабетическую ретинопатию (ДР) и такие симптомы, как слепота у взрослых.
Окислительный стресс может привести к ухудшению состояния при неврологических заболеваниях, таких как болезнь Альцгеймера, болезнь Паркинсона и расстройство аутистического спектра. Флавоноиды, разновидность антиоксидантов, которые борются с окислительным стрессом в организме, помогают снизить выработку активных форм кислорода (АФК) в основном за счёт предотвращения образования свободных радикалов, но также частично за счёт активации глиоксалазного пути путём увеличения транскрипции глутатиона и субъединиц, входящих в состав глутатиона, для повышения внутриклеточного уровня глутатиона.
Основные метаболические пути в глиоксалазном цикле
Хотя глиоксалазный путь является основной метаболической системой, снижающей уровень метилглиоксаля в клетке, было обнаружено, что другие ферменты также преобразуют метилглиоксаль в соединения, не образующие AGE. В частности, 99% метилглиоксаля перерабатывается глиоксалазным путём, в то время как менее 1% метаболизируется в гидроксиацетон с помощью альдо-кето-редуктаз (AKR) или в пируват с помощью альдегиддегидрогеназ (ALDH). Были обнаружены и другие реакции, в результате которых образуется MG, который также участвует в глиоксалазе. К таким реакциям относятся катаболизм треонина и ацетона, перекисное окисление липидов, аутоокисление глюкозы и деградация гликозилированных белков.
Пока мы молоды, глиоксалазная система организма хорошо нейтрализует метилглиоксаль.
Но с возрастом глиоксалазная система работает все хуже. У человека глиоксалазная система изначально недостаточно сильна.
И поэтому все же даже в молодом возрасте накапливается некоторое количество конечных продуктов гликирования.
По мере их накопления снижается и мощность глиоксалазной системы.
Снижение эффективности глиоксалазной системы приводит к тяжелым последствиям и все более быстрому старению.
Когда глиоксалазная система уже не справляется, и образование конечных продуктов гликирования ускоряется,
то начинаются неблагоприятные последствия для организма человека:
Снижается эластичность сосудов организма. Такие сосуды не могут эффективно сужаться и расширяться
– возникает гипертоническая болезнь (повышенное артериальное давление).
Начинает развиваться атеросклероз сосудов с последующими опасными болезнями сердца и мозга.
Конечные продукты гликирования нарушают работу генов.
Связывание конечных продуктов гликирования с рецепторами конечных продуктов гликирования активирует сигнальный путь NF-kB,
который начинает стимулировать системное воспаление во всем организме, резко возрастает вероятность заболеть раком.
Гиперактивация рецепторов конечных продуктов гликирования еще сильнее снижает эффективность работы глиоксалазнаой системы.
Снижение эффективности глиоксалазной системы ведет к нейродегенеративным заболеваниям мозга (старческое слабоумие, болезнь Альцгеймера и т.д.).
Гиперактивация рецепторов конечных продуктов гликирования из-за их накопления ведет к возрастному ожирению.
Потенциальные подходы в борьбе с конечными продуктами гликирования.
КПГ являются объектом многих биомедицинских исследований. Разрабатываются подходы, предотвращающие образование КПГ, способствующие разрушению сшивок, сформированных под действием КПГ, и нейтрализующие их эффекты.
В лабораторных условиях было показано, что формированию КПГ препятствую:
витамин C, бенфотиамин, пиридоксамин, альфа-липоевая кислота, таурин, пимагедин, аспирин, карнозин, метформин, пиоглитазон и пентоксифиллин. Некоторые вещества, такие как пимагедин, могут ограничивать формирование КПГ за счёт взаимодействия с 3-дезоксиглюкозоном.
Исследования на мышах и крысах продемонстрировали, что природные фенолы, такие как ресвератрол и куркумин, могут предотвращать негативные эффекты КПГ.
Известны и соединения, разрушающие сшивки, сформированные под действием КПГ. К их числу относятся алагебриум и родственные ему вещества ALT-462, ALT-486 и ALT-946, а также N-фенацилтиазолиумбромид.

МОЛОДИЛО — ингибитор метилглиоксаля и конечных продуктов гликирования.

